| EU GMP Part IV – ATMPs GMP要点解析(一) |
| 作者:admin 来源:原创 发布日期:2022/5/13 15:51:13 点击次数:2693 |

|
|
转载内容。 非原创和整理
2018年至今是生物制品的又一个春天,细胞治疗和基因治疗产品尤其炙手可热。然而国内对细胞治疗和基因治疗等产品(欧盟称之为ATMP)目前仅有几个技术指导原则而无专门的GMP对其生产和质量管理的各个环节进行规范。本文对欧盟发布的专属于此类产品的ATMPs GMP进行了简译和解析,以供ATMPs研发和生产的各位同仁参考。 ATMP是Advanced Therapy Medicinal Product的英文首字母缩写,当前业界大多将之翻译成“先进治疗药物”或“前沿治疗药物”。它包含了基因治疗药物、体细胞治疗药物以及组织工程产品等等。 EMA于2017年发布了ATMPs的专项GMP,并要求在2018.05.22之前要符合该GMP的要求。该GMP是专用于ATMPs的,如果没有特别指定的部分或引用,在EudraLex V4(即我们常说的EU GMP/GDP)中的其他内容不能直接使用。 此类产品在FDA相关法规中类似的命名是HCT/P(HUMAN CELLS, TISSUES, AND CELLULAR AND TISSUE-BASED PRODUCTS),相关的法规主要是21 CFR Part 1271,以及42 U.S.C的有关章节。42 U.S.C中有原PHS Act Section 351和361的内容(对应42 U.S.C Section 262和264),即业界俗称的“351产品”和“361产品”。21 CFR Part 1271的Subpart D为current Good Tissue Practice (即所谓cGTP)。 国内目前此类产品按照治疗用生物制品管理,尚无针对性的GMP,仅有若干技术指导原则,包括2003年CDE发布的《人基因治疗研究和制剂质量控制技术指导原则》、《人体细胞治疗研究和制剂质量控制技术指导原则》, 2016年CDE发布的《细胞治疗产品研究与评价技术指导原则(试行)》,国家卫生计生委与食品药品监管总局2015年发布的《干细胞制剂质量控制及临床前研究指导原则(试行)》等,这些技术指导原则中也仅仅是要求了某些过程要符合GMP。 EMA的这份可独立运用的GMP可谓开ATMPs规范之先河,发布之后褒贬不一。有的组织称其为开创性举措,有的组织则认为其拉低了ATMPs的GMP管理水平。但不管怎样,这份GMP都可以作为我们业界的参考来规范细胞治疗产品的日常管理。 EU GMP Part IV – ATMPs GMP简译及解析 目录
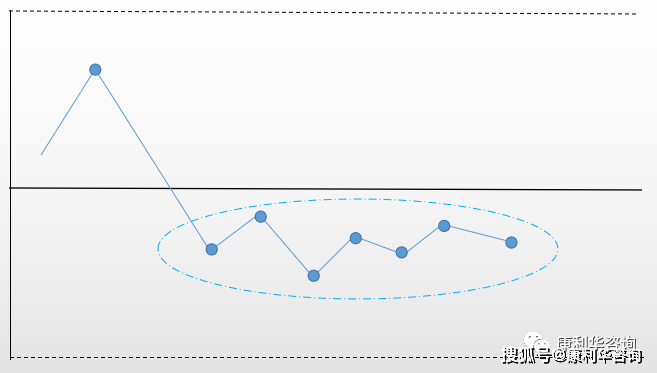
康利华解读: 1、从目录上看,这份文件已经具备了所有的相关要素,是一份独立于其他产品的GMP。 2、该GMP在EU GMP Part I(共9章)以及附录的基础上进行了局部拆解和扩充。例如: Qualification and validation:这个部分没有出现在Part I的正文,是以Annex 15的形式出现。ATMPs GMP则将其纳入了正文。 Seed lot and cell bank system:原本是Annex 2 Manufacture of Biological active substances and Medicinal Products for Human Use中的内容。ATMPs GMP将其通用性内容收录入正文。 1. Introduction 本部分包含了范围和一般原则两个方面的内容。尽管大题目是“引言”,但实际行文上整合了药品质量体系(PQS)的内容。 1.1 Scope 1.10.Compliance with good manufacturing practice (“GMP”) is mandatory for all medicinal products that have been granted a marketing authorisation. Likewise, the manufacture of investigational medicinal products must be in accordance with GMP. Advanced therapy medicinal products that are administered to patients under Article 3(7) of Directive 2001/83/EC (so called “hospital exemption”) must be manufactured under equivalent quality standards to the manufacturing of advanced therapy medicinal products with a marketing authorisation. 简译: 所有上市药品均必须符合GMP。临床用药品(IMP)也同样必须符合GMP。 在Directive 2001/83/EC Article 3(7)项下描述的用于患者的ATMPs的生产必须采用与具有上市许可的ATMPs生产等同的标准。 康利华观点: 1、上市药品以及临床用药品生产要符合GMP的要求是已经众所周知的,讨论点在于临床用药品执行GMP的严格程度。 2、在这一段,提到了所谓“医院豁免”,这是贴近细胞治疗产品的使用情况的。以前在国内外尚未立法时,细胞治疗产品是作为一项针对患者的“定制”治疗技术出现的,没有严格遵照药品进行管理。根据这一段的要求,“医院豁免”产品需要采取与上市产品相同或等同的生产条件来进行生产,而不是像以前只是具备医疗条件。 本段引用的“医院豁免”的相关内容如下表: Directive 2001/83/EC Article 3(7) Any advanced therapy medicinal product, as defined in Regulation (EC) No 1394/2007, which is prepared on a nonroutine basis according to specific quality standards, and used within the same Member State in a hospital under the exclusive professional responsibility of a medical practitioner, in order to comply with an individual medical prescription for a custom-made product for an individual patient. 简译:第1394/2007号法规(EC)所定义的任何先进治疗药物是根据特定质量标准在非常规基础上制备的,并在同一成员国的医院内使用,由医生全权负责,以遵守为个人患者定制产品的个人医疗处方。 Manufacturing of these products shall be authorised by the competent authority of the Member State. Member States shall ensure that national traceability and pharmacovigilance requirements as well as the specific quality standards referred to in this paragraph are equivalent to those provided for at Community level in respect of advanced therapy medicinal products for which authorisation is required pursuant to Regulation (EC) No 726/2004 of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency. 简译:这些产品的生产应由成员国主管当局授权。会员国应确保国家可追溯性和药物警戒要求,本款所指的具体质量标准等同于需要许可的先进治疗药品所规定的标准。 1.11. Article 5 of Regulation (EC) No 1394/2007 mandates the Commission to draw up guidelines on good manufacturing practice specific to advanced therapy medicinal products ("ATMPs"). Article 63(1) of Regulation (EU) No 536/2014 also empowers the Commission to adopt and publish detailed guidelines on good manufacturing practice applicable to investigational medicinal products. 简译: EC 1394/2007的Article 5 授权委员会制定ATMPs的GMP; EU 536/2014 Article 63(1)授权委员会通过并发布临床用药(IMP)的GMP。 康利华观点: 这段阐述了ATMPs以及IMPs的GMP由委员会负责起草、通过和发布。明确了这些GMP的法律地位。 引用的法规: Regulation (EC) No 1394/2007 of the European Parliament and of the Council of 13 November 2007 on advanced therapy medicinal products and amending Directive 2001/83/EC and Regulation (EC) No 726/2004 (OJ L324, 10.12.2007, p.121). Regulation (EU) No 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/EC (OJ L158, 27.5.2014, p.1) 1.12.These Guidelines develop the GMP requirements that should be applied in the manufacturing of ATMPs that have been granted a marketing authorisation and of ATMPs used in a clinical trial setting. These Guidelines do not apply to medicinal products other than ATMPs. In turn, the detailed guidelines referred to in the second paragraph of Article 47 of Directive 2001/83/EC and Article 63(1) of Regulation (EU) No 536/2014 do not apply to ATMPs, unless specific reference thereto is made in these Guidelines. 简译: 指南描述了应当在上市ATMPs以及临床试验用ATMPs生产中运用的GMP要求。 指南不适用于非ATMPs。 除非另有说明, Directive 2001/83/EC Article 47第二段中提到的指南以及EU 536/2014 Article 63(1)不适用于ATMPs。 康利华观点: 明确了适用范围。由于ATMPs的特殊性,通用GMP原则不能完全适用于此类产品。 引用的法规: Article 47 of Directive 2001/83/EC:描述了关于Safety features的要求。 Article 47 of Directive 2001/83/EC提到的指南为Directive 85/374/EEC,liability for defective products Article 63(1) of Regulation (EU) No 536/2014:要求临床用药符合GMP。 1.13. Throughout these Guidelines, the term “ATMP” should be understood as referring to both advanced therapy medicinal products that have been granted a marketing authorisation, and advanced therapy medicinal products that are being tested or used as reference in a clinical trial (i.e. advanced therapy investigational medicinal products). When specific provisions are only relevant for advanced therapy medicinal products that have been granted a marketing authorisation, the term “authorised ATMPs” is used. When specific provisions are only relevant for advanced therapy investigational medicinal products, the term “investigational ATMPs” is used. 简译: 此段定义了几个术语: “authorised ATMPs”指的是已经获取上市许可的ATMPs; “investigational ATMPs”指的是临床试验用ATMPs。 1.14.No provision in these Guidelines (including the risk-based approach) can be regarded as derogation to the terms of the marketing authorisation or clinical trial authorisation. It is noted, however, that non-substantial amendments can be made to the procedures and information stated in the investigational medicinal product dossier without the prior agreement of the competent authorities. Throughout this document, the term “clinical trial authorisation” should be understood as including also non-substantial amendments that have been made to the investigational medicinal product dossier. 简译: 本指南中的任何条款(包括基于风险的方法)均不得视为对上市许可或临床试验许可条款的减损。 未经主管当局事先同意,可以对临床用药档案中所述的程序和信息作出非实质性的修改。在本文件中,“临床试验许可”一词应理解为还包括对临床用药档案所作的非实质性修改。 康利华观点: 1、这份GMP中有一些结合了ATMPs特点的要求,当与上市许可或临床试验许可的要求冲突时,应遵循上市许可或临床试验许可; 2、非实质性修改一般指不影响受试者权益、安全和健康,与临床试验的目的或终点无关的信息修改,例如对伦理委员会已批准方案的修订可能会出现这种情况。这里描述的是不需要“事先”同意,但事后应当有书面资料和过程中的记录存档。 1.15. These Guidelines do not intend to place any restrain on the development of new concepts of new technologies. While this document describes the standard expectations, alternative approaches may be implemented by manufacturers if it is demonstrated that the alternative approach is capable of meeting the same objective. Any adaptation applied must be compatible with the need to ensure the quality, safety, efficacy and traceability of the product. Additionally, it is stressed that the terms of the marketing/clinical trial authorisation should be complied with. 简译: 指导原则不对新技术的新概念的发展施加任何限制。 本文件描述了基本要求,但如果证明替代方法能够满足相同的目标,则生产企业可以实施替代方法。 任何适用的适应性变化必须与确保产品质量、安全、有效性和可追溯性的需要相一致。 应遵守上市/临床试验许可的条款。 康利华观点: 这一条强调了以下几点: 1、无论如何改变,都要遵守上市许可/临床试验许可的条款要求; 2、本GMP描述了ATMPs生产和质量管理的基本要求,原则上应遵照执行。实际上欧美法规、ICH指南等等一般用词为“should”,虽然委婉,但不能由于不是“must”而不做,如果遵照这些条款去做,在法规符合性层面就不会有太大的问题; 3、允许进行适应性的改变,但强调的是“等同性”。要能够达到本GMP中设定的目标。 Role of marketing authorisation holder / sponsor 1.16. For the manufacturer to be able to comply with GMP, cooperation between the manufacturer and the marketing authorisation holder (or, in the case of investigational ATMPs, the manufacturer and the sponsor) is necessary. 简译: 为使生产企业符合GMP,在生产企业与MAH之间的合作是必要的(若为临床试验用ATMPs,则是生产企业和sponsor)。 康利华观点: 1、MAH/sponsor与生产企业之间的合作包括了商务、注册、法规符合等多方面的内容,MAH要对上市后产品质量负责。因此,对生产企业的GMP符合性的审查/检查/合作是保证手段之一。 2、如果生产企业与MAH/sponsor属于同一法律实体,那么在管理上是有优势的,当出现各种问题时便于统一协调处理。而当生产企业是CMO时,由于不是同一法律实体,在工作协调方面会出现迟滞甚至断层,这个时候双方保持良好的沟通与协作至关重要。 1.17. The manufacturer should comply with the specifications and instructions provided by the sponsor/marketing authorisation holder. It is the responsibility of the sponsor/marketing authorisation holder to ensure that the specifications/instructions submitted to the manufacturer are in accordance with the terms of the clinical trial authorisation/marketing authorisation. Variations thereto should be notified immediately. 简译: 生产企业应当符合代理/MAH提供的质量标准和指令。 代理/MAH有责任确保提供给生产企业的质量标准和指令符合临床试验许可/上市许可的要求。 相关的变更应立即通报。 康利华观点: 1、这一条明确了双方的责任。生产企业应当按照MAH/Sponsor提供的工艺、检验方法、质量标准进行生产和检验。而MAH/Sponsor提供的工艺、检验方法、质量标准等应与上市许可以及临床试验许可保持一致并准确无误。这些内容应当作为双方质量协议的一部分。 2、生产和检验过程中有可能会发生变更,这些变更有可能会影响到已获批的上市许可/临床试验许可,因此一旦发生此类变更,应及时互通消息,以免造成法规符合性的影响。这一点要给予足够的关注,变更控制引入国内的法规中已经有一段时间,但企业关注的要么是注册文件本身的变更,要么关注的是生产过程中的变更,对两者之间的联系没有重视。经常出现的问题是注册文件已经递交了补充申请/变更申请,而生产和质量部门尚未启动内部变更程序,反之亦然。 1.18. It is important that marketing authorisation holders/sponsors communicate swiftly to the manufacturer any information that is relevant to the manufacturing process, as well as any information that may have an impact on the quality, safety and efficacy of the medicinal product (e.g. history of cell-line). The communication of the relevant information should be exhaustive. 简译: MAH/代理与生产企业进行有关生产工艺以及任何对药品质量、安全性、疗效造成负面影响的信息(例如细胞系的历史)的快速沟通是至关重要的。 沟通应充分。 康利华观点: 1、这里强调了“快速”,使用的英文单词是“swiftly”,这个意义上相当于“immediately”,也就是说不要拖延。这种沟通机制不但适用于ATMPs,也适用于化学药品和中药类产品。 2、至于哪些信息可能会对药品的质量、安全性、疗效造成负面影响甚至是不可挽回的影响,需要企业结合对产品的理解,对工艺的理解以及风险评估来确定。应当建立有关质量信息沟通的管理程序,负责沟通的人员应当在产品、工艺、质量等方面有丰富的经验,以便及时、有效的传递这些信息,不至于由于不理解、不熟悉而产生误导,例如细胞建系这种专业性非常强的操作与管理。 1.19. In turn, manufacturers should inform the marketing authorisation holder/sponsor of any information that is gathered in the context of the manufacturing activities and that is relevant for the quality, safety or efficacy of the medicinal product. 简译: 生产企业也应通知MAH/代理在生产过程中采集到的任何信息以及与药品质量、安全性和药效相关的信息。 康利华观点: 生产是第一线,会获得大量的第一手信息。这些原始信息或数据对偏差原因的分析、CAPA的充分性、变更的合理性等等都有非常重要的作用。 1.20. The obligations of the marketing authorisation/sponsor holder and the manufacturer and vis-à-vis each other should be defined in writing. In the case of investigational products, the agreement between the sponsor and the manufacturer should specifically provide for the sharing of inspection reports and exchange of information on quality issues. 简译: MAH/代理和生产企业以及相互之间的义务应有书面规定。 临床用药:代理和生产企业之间的协议应当明确规定检查报告的共享以及质量方面的信息交换。 康利华观点: 1、MAH/代理和生产企业的权利和义务应当有书面协议进行约束。清楚的描述各自应当承担的责任。 2、目前许多企业在相互之间合作时(尤其涉及国际化项目时),所签署的协议往往注重的是商业方面的约束和限制,鲜有明确具体的质量条款。这在生产过程中或是技术转移过程中往往会带来多种不良影响,造成产品报废或转移失败,无法获得及时有效的技术支持。 1.2. General principles 1.21. Quality plays a major role in the safety and efficacy profile of ATMPs. It is the responsibility of the ATMP manufacturer to ensure that appropriate measures are put in place to safeguard the quality of the product (so-called “pharmaceutical quality system”). 简译: 质量在ATMPs的安全性和疗效方面很重要。 ATMP生产企业有责任确保采取适当的措施保证产品质量。(即所谓“药品质量体系”) 康利华观点: 1、强调了质量的重要性。不但ATMPs是这样,其他类别的产品质量也是非常重要。 2、强调了进行ATMP的生产企业要建立PQS。要注意的是,GMP的实施并非质量保证的唯一手段,行业指南、工业指南、国标、ISO系列、精益生产、6西格玛管理等等都是可以参考的措施。 Pharmaceutical Quality System 药品质量体系 1.22. 'Pharmaceutical quality system' means the total sum of the arrangements made with the objective of ensuring that medicinal products are of the quality required for their intended use. 简译: “药品质量体系”是为了保证药品符合预期用途,而进行的有组织的安排的总和。 康利华观点: 1、这条与EU GMP 第一章 Pharmaceutical Quality System的描述是一致的。 2、 体系通过文件和相应的措施来实现,但体系≠文件,建立体系是一个系统化的工程,并不是拥有一套优质的文件或是曾经通过FDA/欧盟/NMPA认证的文件就等于完成了体系。体系的建立、实施、维护同等重要。 1.23.The size of the company and complexity of the activities should be taken into consideration when designing a pharmaceutical quality system. Senior management should be actively involved to ensure the effectiveness of the pharmaceutical quality system. While some aspects may be company-wide, the effectiveness of the pharmaceutical quality system is normally demonstrated at site level. 简译: 在设计药品质量体系时,应对公司活动的规模以及复杂性加以考虑。 高层管理人员应当积极参与,以确保药品质量体系的有效性。 虽然某些方面可能适用于全公司,但药品质量体系的有效性通常通过整个现场的水平得到证明。 康利华观点: 1、企业负责人和高层管理人员对质量体系运行有着很重要的作用。各种生产和质量活动都需要依靠组织安排和资源协调来实施。 2、生产和质量活动通过形成具体的文件来执行,执行的水平会反映出体系的运行情况。例如近期FDA公布的一封警告信中有如下描述:『清洁操作开始于2019年5月22日,约15:40(下午3:40),结束于某时间点,持续时间超过n小时。清洁结束后检查官要求查看设备日志,从2019年1月到这次检查,大约有85个“C类”清洁条目。检查官询问公司的总经理助理,为什么当检查官在场的时候清洁房间和某设备要花上超过n小时,而其他日期是30分钟到1.5小时之间。两次提出这个问题,但没有得到答案。』 1.24. Compliance with Good Manufacturing Practice (“GMP”) is an essential part of the pharmaceutical quality system. In particular, through the pharmaceutical quality system it should be ensured that: (i). the personnel are adequately trained and there is clear allocation of responsibilities; (ii). the premises and equipment are suitable for the intended use and that there is appropriate maintenance thereof; (iii). there is an adequate documentation system that ensures that appropriate specifications are laid down for materials, intermediates, bulk products and the finished product, that the production process is clearly understood, and that appropriate records are kept; (iv). the manufacturing process is adequate to ensure consistent production (appropriate to the relevant stage of development), the quality of the product, and the compliance thereof with the relevant specifications; (v). there is a quality control system which is operationally independent from production; (vi). arrangements are in place for the prospective evaluation of planned changes and their approval prior to implementation taking into account regulatory requirements (i.e. variations procedure in the case of authorised ATMPs, or authorization procedure of a substantial modification of a clinical trial in the case of investigational ATMPs), and for the evaluation of changes implemented; (vii). quality defects and process deviations are identified as soon as possible, the causes investigated, and appropriate corrective and/or preventive measures are taken; and (viii). adequate systems are implemented to ensure traceability of the ATMPs and of their starting and critical raw materials. 简译: GMP符合性是药品质量体系的基础。质量体系应能确保: (i). 人员得到充分的培训,职责划分明确; (ii). 配备符合预期用途的设备设施并适当维护; (iii). 应有合乎需要的文件体系,确保制定了物料/中间产品/待包装品/成品的质量标准,确保生产工艺得到清晰的理解以及保存适当的记录; (iv). 生产工艺足以确保生产的连续性,始终如一的保证产品质量以及符合相关的质量标准。 (v). 具有独立于生产的质量控制体系; (vi). 应有相应规定,对计划内的变更进行预先评价,在变更批准实施前考虑法规要求(即authorised ATMPs的变更程序,或investigational ATMPs临床试验发生实质性变更的许可程序),对变更实施后进行评价。 (vii). 尽早识别质量缺陷和工艺偏差,进行原因调查以及采取适当的纠正和/或预防措施。 (viii). 执行合乎需要的制度以确保ATMPs以及起始物料、关键原材料的追溯性。 康利华观点: 1、这条与EU GMP 第一章 Pharmaceutical Quality System的描述是基本一致的,语言描述略有不同。 2、强调了GMP是药品质量体系的基础。企业可在打好基础的情况下,引入更多的质量保证手段或措施。 3、这条描述了要得到保证的要素,包括了人员培训、职责、物料与产品、文件体系、偏差与变更、CAPA、工艺管理、QC体系、可追溯性等等。尽管只有8条,但涵盖了质量管理的重要方面。 1.25. A continuous assessment of the effectiveness of the quality assurance system is important. Results of parameters identified as a quality attribute or as critical should be trended and checked to make sure that they are consistent with each other. The manufacturer should conduct self-inspections as part of the pharmaceutical quality system in order to monitor the implementation and respect of good manufacturing practice and to propose any necessary corrective measures and/or preventive actions. Records should be maintained of such self-inspections and any corrective actions subsequently taken. 简译: 对质量保证体系有效性的连续评价至关重要。 识别为质量属性或关键参数的结果应当进行趋势分析和检查,以保证它们彼此一致。 生产企业应将自检作为药品质量体系的组成部分,以监控GMP的实施和遵守情况,提出所需的纠正措施和或预防措施。应当保存自检记录以及之后采取的纠正措施记录。 康利华观点: 1、质量保证体系的维护是现场检查和日常运行经常会出现问题的一个方面。发现问题以及防患于未然的一个有效的手段是实施定期内部审计(自检),通过具备检查经验和实践经验的自检小组的定期检查来发现体系存在的缺陷并采取措施纠正或预防,以维持体系的连续正常运转。 2、质量属性与工艺参数或中控参数是相关联的。质量属性与工艺参数会根据风险评估的结果分为关键与非关键,例如影响关键质量属性CQAs的工艺参数一般会定义为关键工艺参数CPPs。对于能够量化的属性和参数,采取的手段通常是趋势分析,以便发现变化的走向并通过评估采取相应的措施。 1.26. In the case of authorised ATMPs, quality reviews should be conducted annually to verify the adequacy and consistency of the existing processes, and to highlight any trends and to identify opportunities for product and/or process improvements. The extent of the quality reviews should be determined by the volume of the manufactured products and whether there have been changes introduced to the manufacturing process (i.e. the quality review needs to be more extensive when a high number of lots/ high product quantity has been produced than in case of low number of lots/ low product quantity; the quality review should also be more extensive when changes in the manufacturing process have been introduced during a given year than when no changes have been made). Quality reviews may be grouped by product type where scientifically justified. 简译: authorised ATMPs,应每年进行质量回顾以确认现有工艺的充分性和一致性,强调任何趋势并识别产品和/或工艺的改进点。 质量回顾的范围应通过产品的生产量以及是否向生产工艺引入变更来决定(即批次多/产量高的产品应当比批次少/产量低的产品进行更广泛的质量回顾;发生变更应当比未发生变更进行更广泛的回顾)。 如果有科学论证,质量回顾可按照产品类型分组实施。 康利华观点: 1、这一条阐述了对获得上市许可产品年度质量回顾(Annual Product Quality Review,APQR)的一般规定。 2、年度质量回顾通常每年进行一次,回顾范围是正常生产的所有产品与规格。如果按照产品类型(例如大容量注射剂、冻干粉针等,或是诸如注射剂、口服固体制剂等更大范围的分类方式)分组回顾,需要包含该剂型下所有的产品并要说明分组实施的理由(例如工艺的相似性,相同产品仅有灌装规格不同等)。 3、APQR的内容一般包括原辅料质量情况回顾、供应商管理回顾、过程控制结果回顾、成品质量结果回顾、验证与确认、偏差、变更、CAPA等等方面。回顾时应当根据数据情况采取相应的统计学方法进行分析,而非简单的数据汇总。在进行统计学分析时也要随时注意趋势判异,例如使用控制图进行分析时,要关注超出UCL/LCL的数据以及中心线一侧连续出现9个点(如下图)等异常情况,而不是仅以符合法定标准为判定准则。
1.27. The manufacturer and -when it is a different legal entity- the marketing authorization holder should evaluate the results of the review and assess whether corrective and/or preventive actions are required. 简译: 生产企业和MAH(当两者不是同一法律实体时)应评价回顾结果以及评估是否需要采取纠正和/或预防措施。 康利华观点: 1、常见的MAH与生产企业的关系如下: 1) MAH和生产企业是同一个法律实体; 2) 生产企业与MAH不是同一个法律实体,是MAH的合同生产商(CMO); 2、当MAH和生产企业是同一个法律实体时,运行的是同一个体系,此时APQR按照公司的文件规定执行即可; 3、当生产企业仅为CMO时,需要明确MAH与CMO在APQR中各自的责任。MAH不能减免对APQR报告的审核与评价。
|
| 【关闭】 |